Gehirnfehlbildungen sind häufig und können Ursache von neurologischen Funktionsstörungen und Krampfanfällen sein. Das Team des Instituts für Humangenetik und Genommedizin an der Uniklinik RWTH Aachen hat in Zusammenarbeit mit Kliniken und Instituten der Uniklinik sowie nationalen und internationalen Kooperationspartnern einen Grund für diese Fehlbildungen entdeckt: Genetische Veränderungen im TRiC-Proteinkomplex. Dieser Komplex ist essenziell für die dreidimensionale Faltung von etwa 10 Prozent aller menschlichen Proteine, darunter wichtiger Zellstrukturproteine wie Aktin und Tubulin. Die am 01.11.2024 in der renommierten Fachzeitschrift „Science“ erschienene Studie beschreibt erstmals eine entscheidende Rolle von Genen der Protein-Homöostase für die frühe Embryonalentwicklung des Gehirns und damit eine neue Gruppe genetisch-bedingter Erkrankungen.
Ausgangspunkt der Studie war ein Junge mit einer Entwicklungsverzögerung und Bewegungsstörung, der sich zunächst in der Sektion Neuropädiatrie und Sozialpädiatrie der Klinik für Kinder- und Jugendmedizin der Uniklinik RWTH Aachen vorstellte. Im Rahmen einer Gesamtgenomsequenzierung am Institut für Humangenetik und Genommedizin konnte bei ihm eine neu aufgetretene Veränderung in einer von acht Untereinheiten des TRiC-Komplexes identifiziert werden. „Dieser seltene und neue genetische Befund als Ursache der klinischen Symptome des Jungen erschien uns spannend und plausibel. Ein Fehler in einem so essenziellen Proteinkomplex muss Folgen haben, dachten wir, aber die Beweisführung war aufwändiger. Dennoch zeigt der Fall die enorme Bedeutung eines Einzelpatienten als Keimzelle für neues Wissen“, so Univ.-Prof. Dr. med. Miriam Elbracht, Leiterin des Forschungsgebiets Klinische Genomik. Sie fährt fort: „Unserer anfänglichen Spur konnten wir nur durch Hilfe aller beteiligten Kooperationspartner weiter nachgehen und haben so weitere Betroffene mit gleichartigen genetischen Veränderungen finden und die Hypothese auch funktionell bestätigen können.“
Bedeutung von Genomdaten in der Forschung
In den eigenen Genomdaten von tausenden von Patientinnen und Patienten gelang es dem Forschungsteam in der Folge, zwei weitere Personen mit genetischen Veränderungen in anderen Untereinheiten von TRiC zu identifizieren. „Hier zeigt sich die Bedeutung erhobener genomischer Daten und deren Verknüpfung mit klinischen Befunden“, so Univ.-Prof. Dr. med. Ingo Kurth, Direktor des Instituts für Humangenetik. Die beiden Letztautoren der Studie, Prof. Elbracht und Prof. Kurth, betonen den entscheidenden Benefit der lang angelegten Datensammlung im medizinischen Kontext: „Wir haben hierbei einen starken Rückhalt von den Familien und können durch die Datenspeicherung teils nach vielen Jahren noch Fälle lösen“. Durch internationale Kollaborationen und genetische Plattformen wie „GeneMatcher“ konnten darauffolgend insgesamt 22 unabhängige Patientinnen und Patienten mit genetischen Veränderungen in sieben der acht Untereinheiten von TRiC identifiziert werden.
Ermöglichung der Studie durch interdisziplinäre Zusammenarbeit
An der klinischen Charakterisierung der Betroffenen waren weitere Einrichtungen der Uniklinik RWTH Aachen maßgeblich beteiligt, hierunter die Klinik für Kinder- und Jugendmedizin, die Klinik für Neurologie mitsamt der Sektion Epileptologie, die Klinik für Diagnostische und Interventionelle Neuroradiologie sowie das Institut für Neuropathologie. Prof. Kurth hebt die zentrale Bedeutung von Zentrumsstrukturen für das Projekt hervor: „Unser Medizinisches Zentrum für Erwachsene mit Behinderung (MZEB), das Sozialpädiatrische Zentrum Aachen (SPZ), das Zentrum für Epileptologie und nicht zuletzt das Zentrum für Seltene Erkrankungen Aachen (ZSEA) stehen genau für die hier zusammenlaufenden interdisziplinären Schnittstellen von Forschung und Krankenversorgung, die eine Uniklinik ausmachen.“
Beitrag von TRiC-Veränderungen zu Gehirnfehlbildungen
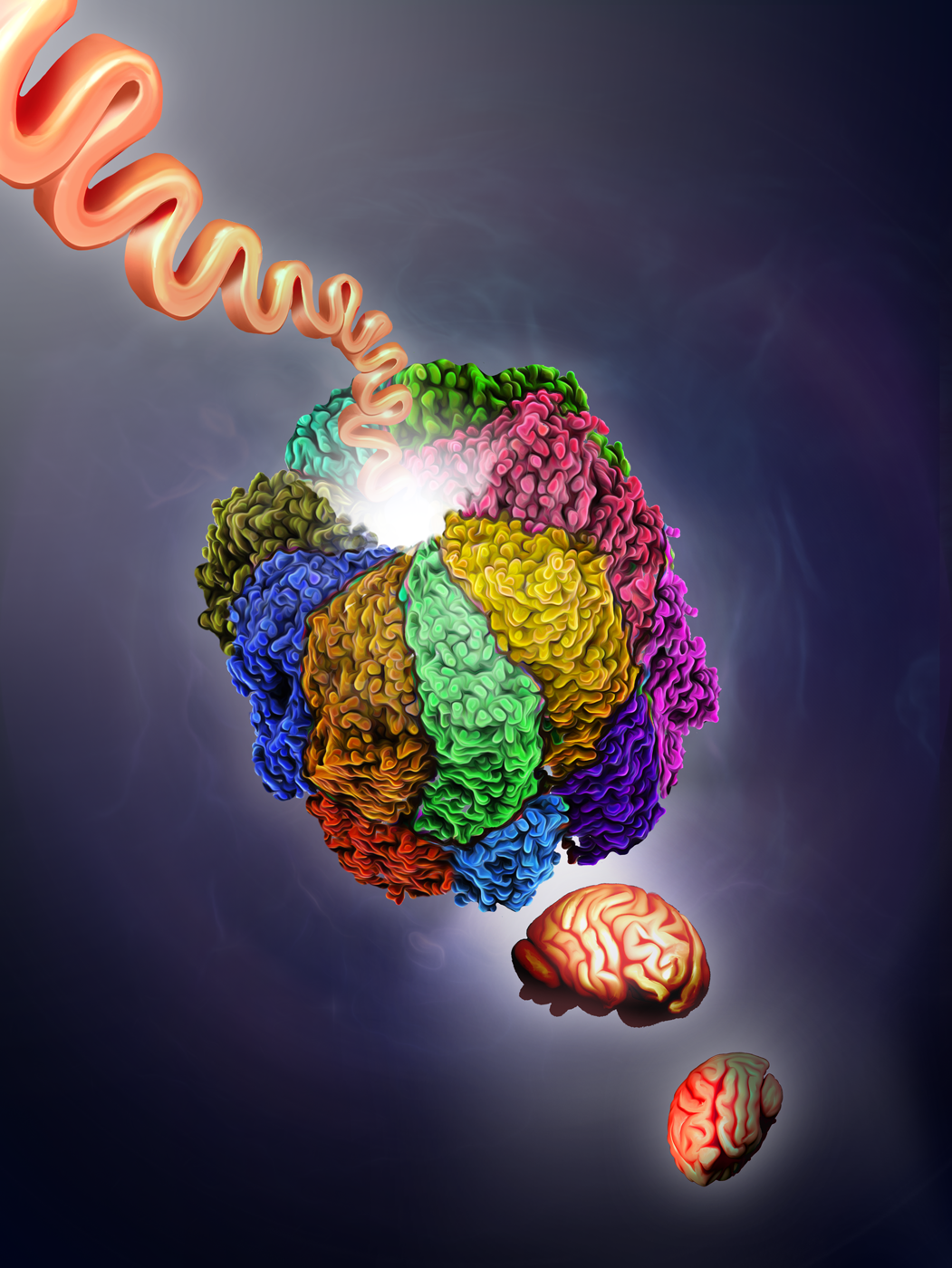
Zusammengesetzt ist TRiC aus acht verschiedenen Proteinuntereinheiten, wobei jede Untereinheit durch ein eigenes Gen kodiert ist. Zweimal acht Untereinheiten bilden die gesamte TRiC Faltungsmaschinerie. „Man kann sich TRiC wie eine Art Fass mit Deckel vorstellen, der auf- und zugehen kann. Abgeschirmt vom äußeren Milieu können im Inneren des Fasses Proteine gefaltet werden. Die richtige dreidimensionale Faltung ist notwendig, damit die Proteine überhaupt funktionieren – ein fundamentales Prinzip der Zellfunktion“, so Prof. Kurth. Wie die genetischen Veränderungen im Einzelnen wirken, ging das Team in verschiedenen Modellsystemen nach, hierunter in Hefen, dem Fadenwurm, dem Zebrafisch und zuletzt auch in Blut- und Hautzellen einiger betroffener Patientinnen und Patienten.
Neben dem hiesigen Institut für Neuropathologie mit seiner Zebrafisch-Einheit sind insbesondere die Zusammenarbeit mit der Gruppe von PD Dr. Andreas Roos der Universität Duisburg-Essen sowie internationale Kooperationen mit der Gruppe von Prof. Judith Frydman der Stanford University (USA) und der Gruppe von Prof. Stephen Pak an der Saint Louis University (USA) hervorzuheben. Durch die Genschere CRISPR/Cas wurden verschiedene Modelle generiert und biochemisch und zellbiologisch sowie durch Transkriptom- und Proteomanalysen untersucht. „Es zeigte sich, dass die 22 genetischen Veränderungen der Patienten und Patientinnen auf unterschiedliche Weise die Funktion von TRiC beeinflussen, letztlich aber alle zu einem Funktionsverlust des Chaperonin-Komplexes führen“, so Dr. rer. nat. Florian Kraft, Erstautor der Studie und Leiter des Bereichs Bioinformatik am Institut für Humangenetik und Genommedizin an der Uniklinik RWTH Aachen. „Insbesondere bei Zellstrukturproteinen wie Aktin und Tubulin scheint der Funktionsverlust von TRiC eine Fehlfaltung hervorzurufen“, so Dr. Kraft. Lena Franken, wissenschaftliche Doktorandin in dem Projekt, ergänzt: „Das Spektrum der genetischen Veränderungen reicht von einem kompletten Funktionsverlust einer TRiC-Untereinheit bis hin zu einem veränderten Timing in der Faltung von Proteinkomplexen.“ Offenbar entsteht insbesondere dann ein Nadelöhr in der Proteinfaltung, wenn der Bedarf an TRiC außergewöhnlich hoch ist. Und dies ist bei der explosionsartigen Entstehung, Vermehrung und Wanderung von Nervenzellen während der frühen Gehirnentwicklung der Fall. Hier wird TRiC als Hochleistungsmaschinerie gebraucht und ein Defekt hat die geschilderten weitreichenden Konsequenzen.
Relevanz der Studie
Es ist damit zu rechnen, dass diese nun bekannte Erkrankungsgruppe von „TRiCopathien“ zukünftig häufiger als Ursache einer Entwicklungsstörung oder Epilepsie aufgedeckt wird. Zunächst liegt eine Therapie wie bei allen Entwicklungsdefekten in der Ferne, allerdings stößt der Befund eine neue Richtung des Denkens über Proteinfaltungserkrankungen an: Fehlgefaltete Proteine wurden bislang eher mit neurodegenerativen Erkrankungen wie Alzheimer oder der Huntington Erkrankung in Zusammenhang gebracht. Dies ändert sich mit den neuen Erkenntnissen und offenbart die Bedeutung einer korrekten Proteinfaltung bereits früh während der Embryonalentwicklung. Eine offene Frage ist, inwiefern häufigere genetische Veränderungen in TRiC, wie sie jeder von uns trägt, die Gehirnentwicklung weniger eindeutig, aber dennoch beeinflussen könnten und so einen Anteil an der Variabilität unserer Gehirnleistungen haben.
Hier gelangen Sie zur Studie, die in der Fachzeitschrift Science veröffentlicht wurde.
Paper: https://www.science.org/doi/10.1126/science.adp8721
„Perspectives“ Artikel in Science: https://www.science.org/doi/10.1126/science.adt0039