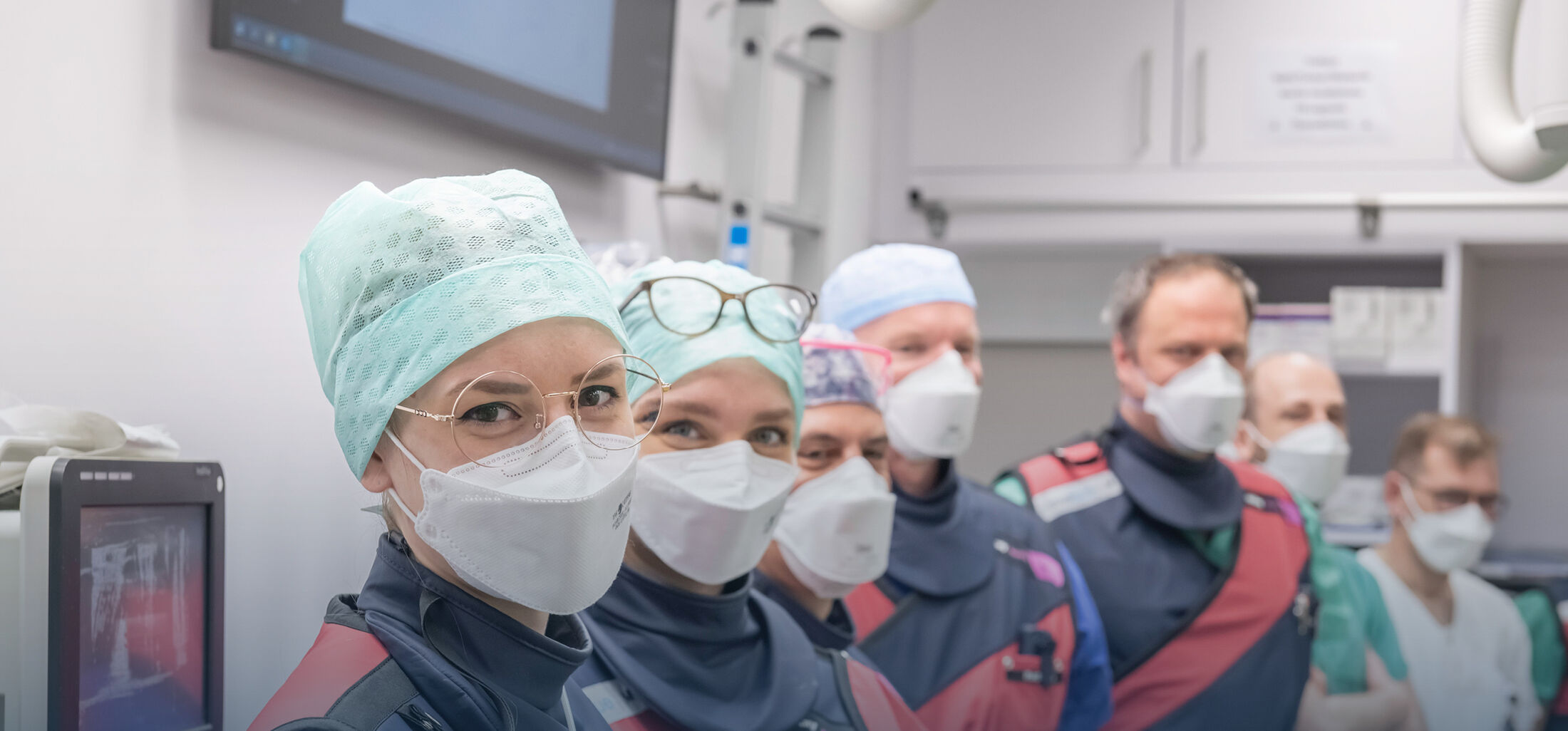
Im Rahmen eines interdisziplinären Kollaborationsprojektes arbeiten die Klinik für Allgemein-, Viszeral- und Transplantationschirurgie der Uniklinik RWTH Aachen, das Joint Research Center for Computational Biomedicine der Uniklinik RWTH Aachen, in Zusammenarbeit mit dem European Molecular Biology Laboratory (EMBL) Heidelberg, an der Anwendung einer innovativen microfluidischen Methodik für die personalisierte Krebsmedizin. Das erste Manuskript dieser Kollaboration unter dem Titel „A microfluidics platform for combinatorial drug screening on cancer biopsies“ wurde nun in Nature Communications, eine der bekanntesten, multidisziplinären Fachzeitschriften, publiziert.
Die Therapie von Krebserkrankungen bleibt trotz deutlicher Fortschritte durch interdisziplinäre Therapieplanung und neu entwickelte Medikamente (z.B. molekular-zielgerichtete Substanzen und Immuntherapien) eine große Herausforderung. Insbesondere für bösartige Tumore des sogenannten Hepato-Pankreatiko-Biliären (HPB)-Traktes (Leber, Gallenwege und Pankreas) ist eine Heilung nur möglich, wenn der Tumor früh entdeckt wird und chirurgisch entfernt werden kann. Die Mehrzahl der HPB-Karzinome wird in fortgeschrittenen Stadien diagnostiziert, sodass eine Tumorentfernung mit dem Ziel einer Heilung des Patienten nicht mehr möglich ist. In diesen Fällen wird der Patient vorrangig mit Chemotherapie behandelt, die allerdings das Überleben in den meisten Fällen nur um wenige Monate verlängern kann. Vor diesem Hintergrund gibt es einen dringenden Bedarf, die Therapie von HPB-Karzinomen zu verbessern.
Eine Möglichkeit hierzu bietet die sogenannte „Personalisierte Medizin“, das meint die Verabreichung einer Therapie, die auf die Besonderheiten des jeweiligen Patienten bzw. des Tumors abgestimmt ist. Die Charakterisierung von Krebs-spezifischen Veränderungen der DNA (des Genoms), der RNA oder der Eiweiße (Proteine) hat im letzten Jahrzehnt zu einer massiven Zunahme des Wissens über Krebserkrankungen geführt. Die Kenntnis bestimmter Mutationen wirkt sich schon heute auf die Therapieplanung bestimmter bösartiger Tumore aus, z.B. bei Leukämien, Lymphomen und dem Haut- oder Dickdarmkrebs. Von vielen Mutationen und anderen strukturellen Veränderungen der Krebszelle, die mit modernen „omics“-Verfahren entdeckt werden können, ist aber letztlich nicht klar, ob und wie sie sich auf das Verhalten des Tumors auswirken und ob sie eine Relevanz für die Therapie besitzen.
Medizinisch relevant und hochinnovativ
Die Uniklinik RWTH Aachen hat daher einen alternativen Weg gewählt, um die Krebstherapie personalisieren zu können: Die Kollaboration basiert auf der Zusammenarbeit von Ingenieuren (Dr. Christoph Merten, Leiter European Molecular Biology Laboratory Heidelberg), Bioinformatikern (Univ.-Prof. Dr. ing. Julio Saez-Rodriguez, Leiter Joint Research Centre for Computational Biomedicine Uniklinik RWTH Aachen und Heidelberg) und Klinikern (Univ.-Prof. Dr. med. Thorsten Cramer, Leiter Forschungsbereich „Molekulare Tumorbiologie“ an der Uniklinik RWTH Aachen und Univ.-Prof. Dr. med. Ulf P. Neumann, Direktor der Klinik für Allgemein-, Viszeral- und Transplantationschirurgie der Uniklinik RWTH Aachen).
Tumormaterial von Patienten mit Pankreaskarzinom wurde in der Arbeitsgemeinschaft von Dr. Merten in einem dort entwickelten mikrofluidischen System mit unterschiedlichen Chemotherapeutika stimuliert. Das Team um Prof. Saez-Rodriguez hat die Ergebnisse im Anschluss mathematisch modelliert und so die Aktivität bekannter, tumorfördernder Signalwege in den einzelnen Tumorproben charakterisiert. Diese Analysen zeigten ausgeprägte Unterschiede zwischen den einzelnen Patienten, wodurch unterstrichen wird, dass Tumore eine individuelle Signatur von tumorfördernden Signalwegen besitzen. Diese Ergebnisse lassen vermuten, dass pharmakologische Hemmstoffe dieser Signalwege einen therapeutischen Effekt haben können und dass die Verabreichung dieser Medikamente insbesondere nach vorheriger Testung des Ansprechens sinnvoll ist. Vor diesem Hintergrund könnte die entwickelte mikrofluidische Analyse zukünftig einen besonderen Stellenwert im Rahmen einer personalisierten Krebsmedizin haben.