Forschungsgruppe: Regulation der Entzündung durch mechanische Kräfte
Unsere Arbeitsgruppe erforscht die Rolle mechanischer Kräfte in diversen Zelltypen und Geweben im menschlichen Körper, ein Bereich, der als Mechanobiologie bezeichnet wird. Im Fokus steht dabei die Mechanotransduktion – also die Umwandlung mechanischer Signale in biochemische Zellantworten. Insbesondere betrachten wir die Regulation von Entzündungsprozessen durch mechanische Einflüsse, die für die Heilung verletzter Gewebe und die Abwehr von Krankheitserregern entscheidend sind. Ein besonderer Schwerpunkt unserer Arbeit liegt dabei auf der Untersuchung von ADAM-Proteasen und ihren Regulatoren, welche als wichtige Schlüsselmoleküle für diese Prozesse gelten. Ziel ist es, durch unsere Grundlagenforschung neue Ansätze für die Entwicklung von Medikamenten, Medizinprodukten und Therapiestrategien zu schaffen.
Unsere Untersuchungen umfassen verschiedene Gewebearten, da mechanische Kräfte im gesamten Körper eine Rolle spielen. Derzeit konzentrieren wir uns auf vier Schwerpunkte:
Gefäßzellen (insbesondere Endothelzellen)
Lungenzellen (insbesondere Epithelzellen der Lungenbläschen)
Hautzellen (insbesondere Keratinozyten und Fibroblasten)
Zellen des Knochenauf- und abbaus (insbesondere Osteoklasten und Osteoblasten)
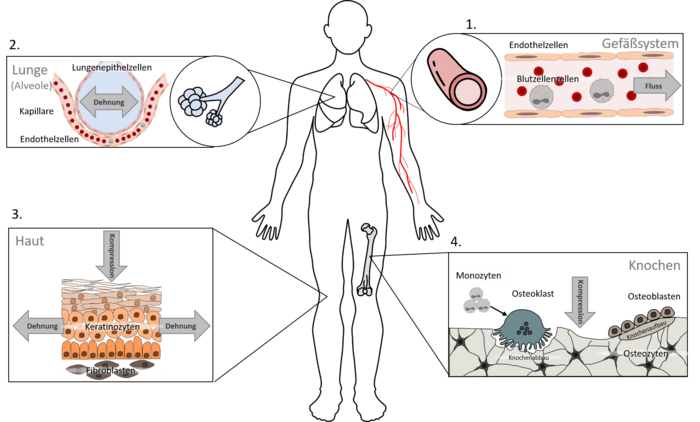
Elementar für die Untersuchung mechanobiologischer Fragestellungen ist natürlich auch die Integration mechanischer Kräfte in unsere Zellkulturexperimente. Hierzu können wir, insbesondere dank der Graduiertenschule ME3T (www.me3t.rwth-aachen.de), auf ein breites interdisziplinäres Netzwerk zurückgreifen. So können wir Zellen nicht nur unter Flussbedingungen kultivieren, sondern auch dehnen (AG Merkel, Institut für Biologische Informationsprozesse – Mechanobiologie, Forschungszentrum Jülich GmbH), komprimieren (AG Fischer, Klinik für Zahnärztliche Prothetik und Biomaterialien) und künstlich verletzen. Unsere Kooperationen erlauben uns außerdem unsere Untersuchungen auch in komplexen Hautmodellen (AG Baron, Klinik für Dermatologie und Allergologie), ex vivo isoliert perfundierten Lungen und Gefäßen (AG Martin, Institut für Pharmakologie und Toxikologie) oder in speziellen Tiermodellen (AG Wolf, Klinik für Kieferorthopädie & AG Ludwig, Institut für Molekulare Pharmakologie) durchzuführen.
Unsere bisherigen Ergebnisse zeigen, dass die Flusskultivierung von Endothelzellen eine anti-entzündliche, protektive Wirkung hat. Beispielsweise beeinflusst sie die ADAM17-Adapterproteine iRhom1 und iRhom2 und fördert die Überlebensfähigkeit der Zellen durch eine erhöhte ADAM15-Expression. Zudem konnten wir feststellen, dass das pro-entzündliche Chemokin CX3CL1 durch Flusskultivierung stark reduziert wird, was die Anheftung von Immunzellen an Endothelzellen und damit das Fortschreiten der Entzündung im umliegenden Gewebe vermindert. Jüngste Erkenntnisse zeigen, dass ADAM10 und ADAM17 in Lungenepithelzellen durch Aktivierung des mechanosensitiven Ionenkanals Piezo1 stimuliert werden, was eine neue Verknüpfung zwischen mechanischen Kräften und durch ADAM-Proteasen induzierte Signalkaskaden aufzeigt. So kann die Aktivierung der ADAM-Proteasen für die Freisetzung verschiedenster Signalmoleküle sorgen, die wiederum eine Vielzahl von Entzündungsprozessen auf autokrinem, parakrinem oder endokrinem Weg beeinflussen können. Durch das Verständnis dieses Signalwegs möchten wir die Entwicklung neuer Therapien für entzündungsbedingte Erkrankungen fördern.

Methodisch liegt der Schwerpunkt insbesondere auf zellbiologischen Arbeiten, die aber immer durch molekularbiologische Analysen gestützt werden.
| Zellkultur | Zellbiologische Methoden | Molekularbiologische Methoden |
| • Primärzellisolation | • Proliferation | • qPCR |
| • (Primär-)Zellkultur | • Migration | • Western Blot |
• Anwendung mechanischer Kräfte (Dehnung, Kompression und Fluss) | • Permeabilität • Überlebensfähigkeit • Calcium-Assays | • ELISA • Proteaseaktivitäts-Assays |
• Einsatz pharmakologischer Aktivatoren und Inhibitoren | • Immunofluoreszenz-Färbungen • Durchflusszytometrie |
Hierzu stehen unserer Arbeitsgruppe neben einem Durchflusszytometer (LSRFortessa, BD) auch ein Live Cell Imaging-System zur Verfügung (IncuCyte SX5, Sartorius), welches das Monitoring der Zellen direkt im Inkubator ermöglicht. Gerne stellen wir die Nutzung dieser Systeme auch anderen Arbeitsgruppen in Rücksprache zur Verfügung. Bei Rückfragen können sie sich gerne an Aaron Babendreyer (ababendreyerukaachende) wenden.
Publikationen
- Babendreyer, A.*, Kieselhorst J.*, Rinkens C.*, Lyashenko AM., Düsterhöft S., Jahr H., Craveiro RB., Wolf M., Ludwig A. Downregulation of the metalloproteinases ADAM10 or ADAM17 promotes osteoclast differentiation. Cell Commun Signal 2024;22:322. https://www.doi.org/10.1186/s12964-024-01690-y.
- Rojas-González DM.*, Babendreyer, A.*, Ludwig A., Mela P. Analysis of flow-induced transcriptional response and cell alignment of different sources of endothelial cells used in vascular tissue engineering. Sci Rep. 2023;13:14384. https://www.doi.org/10.1038/s41598-023-41247-6.
- Grannemann C., Pabst A., Honert A., Schieren J., Martin C., Hank S., Böll S., Bläsius K., Düsterhöft S., Jahr H., Merkel R., Leube R., Babendreyer, A.*, Ludwig A*. Mechanical activation of lung epithelial cells through the ion channel Piezo1 activates the metalloproteinases ADAM10 and ADAM17 and promotes growth factor and adhesion molecule release. Biomater Adv. 2023;152:213516. https://www.doi.org/10.1016/j.bioadv.2023.213516.
- Nußbaum SM., Krabbe J., Böll S., Babendreyer, A.*, Martin C.* Functional changes in long-term incubated rat precision-cut lung slices. Respir Res. 2022;23:261. https://www.doi.org/10.1186/s12931-022-02169-5.
- Giese AA.*,Babendreyer, A.*, Krappen P., Gross A., Strnad P., Düsterhöft S., Ludwig A. Inflammatory activation of surface molecule shedding by upregulation of the pseudoprotease iRhom2 in colon epithelial cells. Sci Rep. 2021;11:24230. https://www.doi.org/10.1038/s41598-021-03522-2.
- Babendreyer, A., Rojas-González DM., Giese AA., Fellendorf S., Düsterhöft S., Mela P., Ludwig A. Differential Induction of the ADAM17 Regulators iRhom1 and 2 in Endothelial Cells. Front Cardiovasc Med. 2020;7. https://www.doi.org/10.3389/fcvm.2020.610344.
- Babendreyer, A., Molls L., Simons IM., Dreymueller D., Biller K., Jahr H., Denecke B., Boon RA., Bette S., Schnakenberg U., Ludwig A. The metalloproteinase ADAM15 is upregulated by shear stress and promotes survival of endothelial cells. J Mol Cell Cardiol. 2019;134:51–61. https://www.doi.org/10.1016/j.yjmcc.2019.06.017.
- Babendreyer, A., Molls L., Dreymueller D., Uhlig S., Ludwig A. Shear Stress Counteracts Endothelial CX3CL1 Induction and Monocytic Cell Adhesion. Mediators Inflamm. 2017;2017:1515389. https://www.doi.org/10.1155/2017/1515389.



