Weber Group
Medical Devices
Die Unterstützung durch digitale Systeme hilft entscheidend in der Verbesserung der Versorgung von Epilepsie-Patienten.
Zugleich stellen sich Herausforderungen in Forschung und Entwicklung: Die Genauigkeit und Zuverlässigkeit von Anfallserkennungssystemen wie auch Entscheidungsunterstützungssystemen (CDSS) ist entscheidend, um klinisch nützlich zu sein. Die Datensicherheit muss gewährleistet sein, um die Privatsphäre und Sicherheit von Patienteninformationen zu schützen. Interoperabilität ist erforderlich, damit Geräte und Apps nahtlos in Gesundheitssysteme integriert werden können und müssen mit verschiedenen Plattformen und elektronischen Patientenakten kompatibel sein. Zudem ist ein benutzerfreundliches Design wichtig, damit die Systeme leicht von Personen jeden Alters und mit unterschiedlichem technologischen Verständnis genutzt werden können. Klinische Validierung und regulatorische Genehmigungen sind unerlässlich, da neue Technologien strenge klinische Tests zur Bestätigung ihrer Wirksamkeit und Sicherheit durchlaufen müssen, bevor sie weit verbreitet eingesetzt werden können.
Team
Mohamed Alhaskir, M. Sc.
Dept. of Neurology, Section Epileptology
University of Aachen
Pauwelsstrasse 30
52074 Aachen, Germany
malhaskir@ukaachen.de
Elisabeth Schriewer, M. Sc.
Projektmanagerin
Dept. of Neurology, Section Epileptology
University of Aachen
Pauwelsstrasse 30
52074 Aachen, Germany
eschriewerukaachende

Priv.-Doz. Dr. med. Stefan Wolking
Dept. of Neurology, Section Epileptology
University of Aachen
Pauwelsstrasse 30
52074 Aachen, Germany
swolkingukaachende
Research projects and techniques
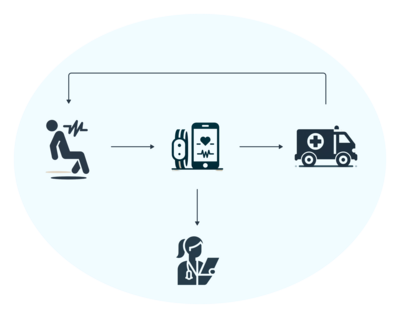
Recognizing that up to 50% of epileptic seizures are undetected and therefore undocumented, our working group is pioneering the creation of EEG-independent seizure detection systems. We are focused on designing a discreet, wearable device that patients can comfortably wear under their clothing. This device is intended to sync with a smartphone app, providing objective measurements of seizure activity. In a novel approach to comprehensive care, this technology is being developed in tandem with a feature to monitor depressive symptoms, which often accompany epilepsy. The algorithms behind these tools leverage diverse methods of artificial intelligence to ensure precision in detecting seizures and monitoring mental health, thus offering a dual advantage. This initiative promises a more holistic treatment strategy for epilepsy, acknowledging the critical interplay between neurological events and mental well-being.
Clinical Decision Support Systems (CDSS) are a transformative force in modern healthcare, offering vital for medical professionals, especially in complex fields like epilepsy care. These digital systems harness vast repositories of medical guidelines, expert knowledge, and pharmacological data—resources that may be beyond the immediate recall of even seasoned practitioners, let alone those without specialized training in neurology.
In the realm of epilepsy, where diagnostic and therapeutic decisions are nuanced and patient-specific, a CDSS serves as an indispensable tool. It filters and consolidates pertinent information, tailoring it to the unique parameters of each case. This not only aids in accurately diagnosing the type of epilepsy but also guides the selection of an optimal therapeutic strategy, considering the intricacies of pharmacology that can influence treatment efficacy and patient safety.
By integrating a CDSS into epilepsy management, clinicians can make more informed decisions backed by a comprehensive, case-adapted synthesis of the latest medical knowledge. This system can streamline workflows, reduce the likelihood of human error, and improve patient outcomes.
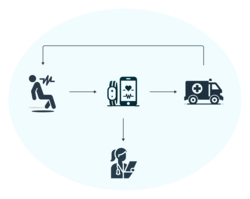
Viele Epilepsiepatient/innen leiden unter komorbid-auftretenden depressiven Symptomen, wie z. B. unter Freud- und Interessenverlust. Dieser Zustand geht häufig mit einer unvollständigen Dokumentation von epileptischen Anfallsereignissen, da diese z.B. sehr milde oder nachts ablaufen, und in der Folge mit einer unzureichenden anfallssupprimierenden Behandlung einher.
Die Studie Assoziation von Anfallsfrequenz und depressiven Symptomen bei Patienten mit Epilepsie untersucht, ob die Anfallsfrequenz bei Epilepsiepatient/innen mit depressiven Symptomen in Verbindung steht. Weiterhin soll geprüft werden, ob die Art der Epilepsie und/oder die medikamentöse Therapie die depressiven Symptome mit beeinflusst. Gleichzeitig sollen Biomarker für die Erfassung depressiver Symptome entwickelt werden.
Dazu werden der MoniKit-Anfallsdetektor zur automatisierten Erkennung epileptischer Anfallsereignisse und die MoniKit-App als elektronisches Anfallstagebuch von den Studienteilnehmenden genutzt. Mit der iTrack Depression App dokumentieren die Patient/innen hingegen depressive Symptome. Zusätzlich erfolgt die Sammlung von Biodaten, wie z. B. der Herzfrequenz, durch die Verwendung einer Fitness-Armbanduhr. Die Nutzung der subjektiven Angaben aus der MoniKit und iTrack Depression App, sowie der objektiven Daten des MoniKit Anfallsdetektors und der Fitnessuhr, ermöglichen eine systematische und fachübergreifende Betrachtungsweise der Krankheitsbilder Epilepsie und Depression.
Die Studie wird durch Fördermittel des Bundesministeriums für Bildung und Forschung (BMBF) finanziert.
Publications
Selected Publication:
- Schwarz N, Seiffert S, Pendziwiat M, Rademacher AV, Brünger T, Hedrich UBS, Augustin PB, Baier H, Bayat A, Bisulli F, Buono RJ, Bruria BZ, Doyle MG, Guerrini R, Heimer G, Iacomino M, Kearney H, Klein KM, Kousiappa I, Kunz WS, Lerche H, Licchetta L, Lohmann E, Minardi R, McDonald M, Montgomery S, Mulahasanovic L, Oegema R, Ortal B, Papacostas SS, Ragona F, Granata T, Reif PS, Rosenow F, Rothschild A, Scudieri P, Striano P, Tinuper P, Taneles GA, Vetro A, Zahnert F, Goldberg EM, Zara F, Lal D, May P, Muhle H, Helbig I, Weber Y. Spectrum of Phenotypic, Genetic, and Functional Characteristics in Patients With Epilepsy With KCNC2 Pathogenic Variants. Neurology 2022;98(20):e2046-e2059. doi: 10.1212/WNL.0000000000200660
- Seiffert S, Pendziwiat M, Bierhals T, Goel H, Schwarz N, van der Ven A, Boßelmann CM, Lemke J, Syrbe S, Willemsen MH, Hedrich UBS, Helbig I, Weber Y. Modulating effects of FGF12 variants on NaV1.2 and NaV1.6 being associated with developmental and epileptic encephalopathy and Autism spectrum disorder: A case series. EBioMedicine. 2022 Sep;83:104234. doi: 10.1016/j.ebiom.2022.104234.
- Vorderwülbecke BJ, Wandschneider B, Weber Y, Holtkamp M. Genetic generalized epilepsies in adults - challenging assumptions and dogmas. Nat Rev Neurol. 2022 Feb;18(2):71-83. doi: 10.1038/s41582-021-00583-9.
- Epi25 Collaborative. Sub-genic intolerance, ClinVar, and the epilepsies: A whole-exome sequencing study of 29,165 individuals. J Hum Genet. 2021 Oct 7;108(10):2024. doi: 10.1016/j.ajhg.2021.08.008
- Galer PD, Ganesan S, Lewis-Smith D, McKeown SE, Pendziwiat M, Helbig KL, Ellis CA, Rademacher A, Smith L, Poduri A, Seiffert S, von Spiczak S, Muhle H, van Baalen A; NCEE Study Group; EPGP Investigators; EuroEPINOMICS-RES Consortium; Genomics Research and Innovation Network; Thomas RH, Krause R, Weber Y, Helbig I. Semantic Similarity Analysis Reveals Robust Gene-Disease Relationships in Developmental and Epileptic Encephalopathies. Am J Hum Genet. 2020 Oct 1;107(4):683-697. doi: 10.1016/j.ajhg.2020.08.00
- Helbig I, Lopez-Hernandez T, Shor O, Galer P, Ganesan S, Pendziwiat M, Rademacher A, Ellis CA, Hümpfer N, Schwarz N, Seiffert S, Peeden J, Shen J, Štěrbová K, Hammer TB, Møller RS, Shinde DN, Tang S, Smith L, Poduri A, Krause R, Benninger F, Helbig KL, Haucke V, Weber Y; EuroEPINOMICS-RES Consortium; GRIN Consortium. A Recurrent Missense Variant in AP2M1 Impairs Clathrin-Mediated Endocytosis and Causes Developmental and Epileptic Encephalopathy. Am J Hum Genet. 2019 Jun 6;104(6):1060-1072. doi: 10.1016/j.ajhg.2019.04.001
- Heyne HO, Singh T, Stamberger H, Abou Jamra R, Caglayan H, Craiu D, De Jonghe P, Guerrini R, Helbig KL, Koeleman BPC, Kosmicki JA, Linnankivi T, May P, Muhle H, Møller RS, Neubauer BA, Palotie A, Pendziwiat M, Striano P, Tang S, Wu S; EuroEPINOMICS RES Consortium; Poduri A, Weber Y, Weckhuysen S, Sisodiya SM, Daly MJ, Helbig I, Lal D, Lemke JR. De novo variants in neurodevelopmental disorders with epilepsy. Nat Genet. 2018 Jul;50(7):1048-1053. doi: 10.1038/s41588-018-0143-7. Epub 2018 Jun 25
- Gardella E, Becker F, Møller RS, Schubert J, Lemke JR, Larsen LH, Eiberg H, Nothnagel M, Thiele H, Altmüller J, Syrbe S, Merkenschlager A, Bast T, Steinhoff B, Nürnberg P, Mang Y, Bakke Møller L, Gellert P, Heron SE, Dibbens LM, Weckhuysen S, Dahl HA, Biskup S, Tommerup N, Hjalgrim H, Lerche H, Beniczky S, Weber Y. Benign infantile seizures and paroxysmal dyskinesia caused by an SCN8A mutation. Ann Neurol. 2016 Mar;79(3):428-36. doi: 10.1002/ana.24580.
- Schubert J, Siekierska A, Langlois M, May P, Huneau C, Becker F, Muhle H, Suls A, Lemke JR, de Kovel CG, Thiele H, Konrad K, Kawalia A, Toliat MR, Sander T, Rüschendorf F, Caliebe A, Nagel I, Kohl B, Kecskés A, Jacmin M, Hardies K, Weckhuysen S, Riesch E, Dorn T, Brilstra EH, Baulac S, Møller RS, Hjalgrim H, Koeleman BP; EuroEPINOMICS RES Consortium; Jurkat-Rott K, Lehman-Horn F, Roach JC, Glusman G, Hood L, Galas DJ, Martin B, de Witte PA, Biskup S, De Jonghe P, Helbig I, Balling R, Nürnberg P, Crawford AD, Esguerra CV, Weber Y*, Lerche H*. Mutations in STX1B, encoding a presynaptic protein, cause fever-associated epilepsy syndromes. Nat Genet. 2014 Dec;46(12):1327-32. doi: 10.1038/ng.3130. *contributed equally
- Weber Y, Storch A, Wuttke TV, Brockmann K, Kempfle J, Maljevic S, Margari L, Kamm C, Schneider SA, Huber SM, Pekrun A, Roebling R, Seebohm G, Koka S, Lang C, Kraft E, Blazevic D, Salvo-Vargas A, Fauler M, Mottaghy FM, Münchau A, Edwards MJ, Presicci A, Margari F, Gasser T, Lang F, Bhatia KP, Lehmann-Horn F, Lerche H.. GLUT1 mutations are a cause of paroxysmal exertion-induced dyskinesias and induce hemolytic anemia by a cation leak. J Clin Invest. 2008 Jun;118(6):2157-68. doi: 10.1172/JCI34438
Further Publications:
- Lerche H, Weber Y (2018 and 2023). Anfallsartige Erkrankungen. S.75-102. In: Sitzer M und Steinmetz H. Lehrbuch Neurologie hoch 2. Urban und Fischer Verlag
- Krey I, Platzer K, Esterhuizen A, Berkovic SF, Helbig I, Hildebrand MS, Lerche H, Lowenstein D, Møller RS, Poduri A, Sadleir L, Sisodiya SM, Weckhuysen S, Wilmshurst JM, Lemke JR, Berkovic SF, Cross JH, Helbig I, Lerche H, Lowenstein D, Mefford HC, Perucca P, Tan NC, Caglayan H, Helbig K, Singh G, Weber Y, Weckhuysen S. Current practice in diagnostic genetic testing of the epilepsies. Epileptic Disord. 2022 Oct 1;24(5):765-786. doi: 10.1684/epd.2022.144
- Boßelmann CM, San Antonio-Arce V, Schulze-Bonhage A, Fauser S, Zacher P, Mayer T, Aparicio J, Albers K, Cloppenborg T, Kunz W, Surges R, Syrbe S, Weber Y, Wolking S. Genetic testing before epilepsy surgery - An exploratory survey and case collection from German epilepsy centers. Seizure. 2022 Feb;95:4-10. doi: 10.1016/j.seizure.2021.12.004. Epub 2021 Dec 17
- Koch H, Weber Y. The glucose transporter type 1 (Glut1) syndromes.Epilepsy Behav. 2018. S1525-5050(18)30348-2.
- Weber Y, Biskup S, Helbig KL, Von Spiczak S, Lerche H. The role of genetic testing in epilepsy diagnosis and management.Expert Rev Mol Diagn 2017, 17:739-750.
- Wolking S, Weber Y. Genetics of epileptic encephalopathies. Aktuelle Neurologie 2015, 42:437-481.
- Weber Y, Nies AT, Schwab M, Lerche H. Genetic Biomarkers in Epilepsy.Neurotherapeutics 2014, 11:324-33.
- Lerche H, Vezzani A, Beck H, Blümcke I, Weber Y, Elger C. New developments in epileptogenesis and therapeutic perspectives. Nervenarzt 2011, 82:978-85.
- Weber Y, Lerche H. Genetics of paroxysmal dyskinesias. Curr Neurol Neurosci Rep 2009, 9:206-11.
- Weber Y, Lerche H (2008). Genetic mechanism in epilepsy. Developmental Medicine and Child Neurology 2008, 50:648-54.